- Hanson
- 最後更新:2021-10-24
不管是藥物或是醫材要使用在人身上都需要經過縝密的研究與臨床試驗以及政府法規的監控。
究竟什麼是臨床試驗呢?各階段Phase I ~PhaseIV所代表的意義又是什麼? 需要花費多少時間?
本篇介紹給還沒進入臨床試驗產業或是有興趣了解的你們!
Note:對於想踏入臨床試驗產業的新鮮人來說這可是面試必考題!!讓我們一起拿下他!
目錄
1. 什麼是臨床試驗?
以發現或證明藥品在臨床、藥理或其他藥學上之作用為目的,而於人體執行之研究。(GCP-第一章第三條之一)
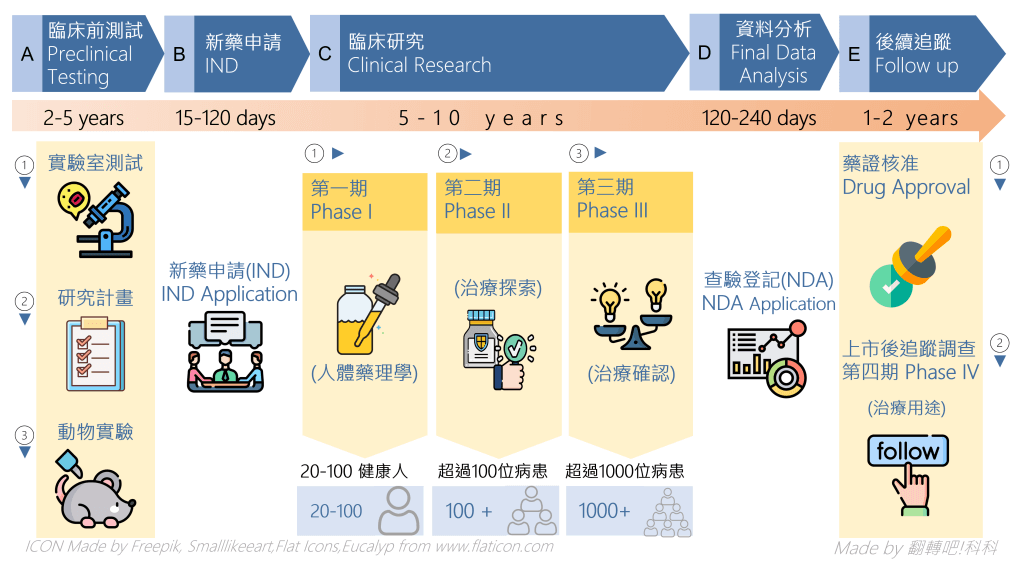
2. 臨床試驗階段的分級有哪些?
第一階段(Phase I,人體藥理學)
第一階段始於新試驗藥品首次用於人體。此階段之研究通常並無治療性之目的,而可能進行於數名或十數名健康志願者(沒有疾病者)或某些特定受試驗者族群參與。此階段之研究可較常為開放性設計,可採用單一劑量組別或多劑量組別設計;若採用多劑量組別設計,不同劑量組別資料將有助於評估後續臨床試驗的劑量選取。(第一期臨床試驗可不設置對照組)
Note : 若是測試治療癌症等末期疾病的效果,則可由少數病人直接參與,主要是瞭解藥物的安全劑量,在人體所能夠承受之最高劑量。
第二階段(PhaseII,治療探索)
第二階段的試驗通常嚴格條件篩選出同質性高的病患族群,探索藥物的療效和安全性,並進行嚴密監測作業並決定第三階段試驗所使用之劑量及治療方法。此階段中,早期採用逐步劑量增加(dose ascending)的設計,後期試驗則可經平行劑量-反應設計(亦可延至第三階段執行),以確認該適應症之劑量-反應關係。第二階段所用的劑量通常(但非絕對)低於第一階段所用的最高劑量。
第二階段臨床試驗的目的還包括:評估其他可能試驗指標、治療方法(包括併用藥品)、目標族群(如輕微或嚴重疾病)等,以供第二階段後續試驗或第三階段試驗之需。初期療效探索試驗可使用各種試驗設計,包括使用同步對照組(concurrent controls)及基準狀況(baseline status)之比較,後續試驗則通常為隨機、同步對照組的試驗,以對某一適應症的療效和安全性進行評估。
第三階段(PhaseIII,治療確認)
第三階段試驗主要目的,為確認於第二階段中所得藥品用於目標適應症及受試驗者是安全及有效的初步證據。以隨機分配、雙盲及對照試驗等方式進行,主要證實藥物療效及安全性,作為上市前的依據。第三階段試驗可更進一步地探索劑量-反應關係,或探討將此藥品使用於更多族群、或用於疾病之不同階段、或與不同藥品合併使用。對需長期給藥的藥品而言,雖然第二階段可進行長期給藥之臨床試驗,但此類臨床試驗通常於第三階段進行,第三階段所執行之試驗提供完整資訊,以支持藥品的適當使用說明。
第四階段(PhaseIV,治療用途)
第四階段試驗起始於藥品核准上市之後。治療用途之試驗之目的超出於先前藥品的安全性、療效、及劑量定義。監測該藥物是否有先前幾個階段沒發現的副作用或是不良反應等情況,試驗設計較為簡單,但是需要大量的病人進行長時間的觀察。此類試驗雖非申請核准之必須,但對藥品最佳用法是相當重要的。此類研究包括各類型,但均須具有正確科學目的。常進行的試驗包括:與其他藥品交互作用、劑量-反應或安全性試驗,以及用來佐證在核准適應症使用之試驗,如死亡率/罹病率試驗、流行病學試驗。
4. 懶人包
Phase I – 確認試驗藥”安全性”(人體耐受劑量與潛在副作用)
Phase II – 找出適當的治療劑量、治療時程與”可能治療的疾病種類”(治療探索)
PhaseIII – 驗證新藥的”療效”
PhaseIV – 了解上市後有無之前未發現的副作用或不良反應。